Trump anuncia a aprovação do medicamento em caráter emergencial após resultados incompletos e sem revisão de especialistas independentes
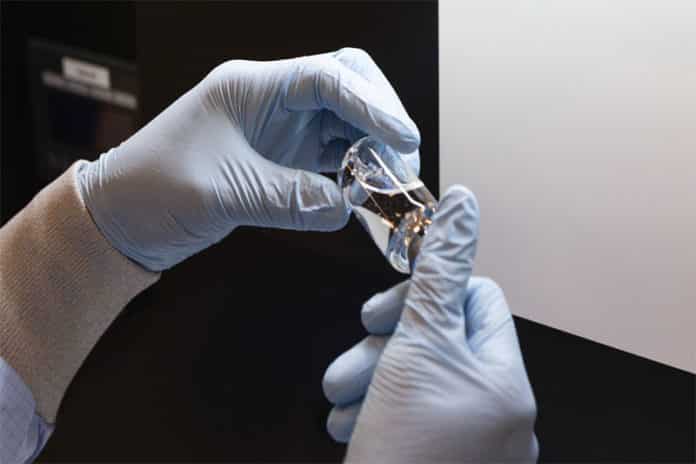
O presidente dos Estados Unidos, Donald Trump, afirmou na sexta-feira que a Administração de Alimentos e Medicamentos (FDA) dos Estados Unidos autorizou o uso emergencial, para o tratamento de pacientes da covid-19, do antiviral experimental remdesivir, um dos remédios mais promissores na luta contra a doença causada pelo coronavírus. O presidente realizou o anúncio em um pronunciamento no Salão Oval ao lado de Daniel O’Day, executivo-chefe da farmacêutica norte-americana Gilead, fabricante do remdesivir. O Governo afirma que está trabalhando para que o medicamento esteja à disposição dos pacientes o quanto antes, e a empresa anunciou que doará um milhão de doses do remédio.
“Queremos agradecer a colaboração que levou o remdesivir até esse ponto e às muitas pessoas que foram parte disso”, disse Trump, de acordo com a rede CNBC. “É realmente uma situação muito promissora”.
A FDA não fez uma aprovação formal do medicamento. Mas a declaração de uma emergência de saúde pública por parte do Governo federal lhe permite autorizar a utilização de determinados medicamentos para combater a emergência na ausência de alternativas, mesmo quando não existem dados completos sobre sua eficácia e sua segurança. Desse modo, o remdesivir se transforma no primeiro medicamento aprovado para a covid-19.
A droga trouxe resultados positivos em um teste clínico federal, que mostrou que o tratamento com remdesivir pode acelerar a recuperação dos pacientes com coronavírus. O teste foi feito com 1.063 pacientes graves, alguns dos quais receberam remdesivir enquanto outros receberam placebo. Os tratados com remdesivir demoraram em média 11 dias para se curar enquanto os tratados com placebo demoraram em média 15 dias. O teste não mostrou uma redução significativa, entretanto, na taxa de mortalidade dos pacientes. “Ficou demonstrado que é um medicamento que pode bloquear o vírus”, disse na quarta-feira o epidemiologista Anthony Fauci, diretor do Instituto Nacional de Alergias e Doenças Infeciosas. “Esse será o padrão de tratamento”.
O estudo, realizado pelo Instituto Nacional de Doenças Infecciosas (NIAID), que faz parte dos Institutos Nacionais de Saúde (NIH), não foi revisado por especialistas independentes e não foi publicado em uma revista científica. É bem incomum que se publiquem os resultados de um teste clínico sem que se tenha superado o processo de revisão, e muitos médicos pedem cautela.
O remdesivir, que foi desenvolvido para tratar o ebola, mas não demonstrou ser efetivo, é um dos remédios mais promissores para se transformar no tratamento padrão da covid. O medicamento detecta o genoma viral e bloqueia a proteína ARN polimerase (RdRp), que multiplica as cópias do vírus. Sem essa proteína, o coronavírus causador da doença vovid-19 não pode se replicar e a infecção fica bloqueada.
Diante da complexidade de dispor de uma vacina contra o patógeno, o foco se voltou aos possíveis tratamentos, e essa atenção fez com que, algumas vezes, se prescinda do método científico na comercialização de medicamentos. Na quarta-feira, no mesmo dia em que o NIAID divulgava os resultados preliminares de seu estudo, a Gilead publicava os primeiros dados de um de seus próprios testes clínicos, que chamava de “promissores”. Apesar das limitações do estudo, que não foi realizado com grupo de controle e não foi revisado por especialistas, o anúncio da Gilead provocou aumentos nas bolsas. Pouco depois, a prestigiosa revista médica The Lancet surpreendentemente publicou o primeiro teste clínico sobre o remdesivir com grupo de controle e revisado por especialistas independentes, e os resultados mostram que o medicamento não trouxe vantagens significativas aos pacientes de covid-19.
Na quinta-feira, a Gilead anunciou que espera produzir mais de 140.000 doses de seu tratamento de dez dias de remdesivir para o final de maio, e que poderá produzir um milhão delas até o final do ano.